 |  | |
Les principales fonctions organiques | ||
 |  |
Ce chapitre n'a pas la prétention d'expliquer toute la chimie organique mais de permettre de savoir de quoi nous allons parler dans les chapitres suivants. A défaut, il permettra au moins de savoir ce que signifie le nom de beta hydroxy dont nous parle si abondamment la publicité.
Les molécules organiques sont considérées par les scientifiques comme des chaines lineaires de carbones sur lequelles se greffent divers groupements, pouvant eux même être basés sur une chaine de carbone. Une chaine carbonée pouvant se ramifier, il peut y avoir plusieurs possibilités pour choisir une chaine linéaire, dans ces condition, la chaine considérée comme principale est la plus longue. La position des groupements sur la chaine est numéroté, cette numérotation peut commencer aussi bien par un bout que par l'autre, par convention, le début de la chaine est celui qui permet d'avoir les numéros les plus bas pour désigner les groupements.
Cette regle souffre des exceptions. Certaines molécules ont leurs atomes numérotés selon l'alphabet grec. D'autres, pour des raisons de cohérence sont représentés différement. Par exemple, les acides aminés sont considérés comme des chaines de 1 atome de carbone sur lequel se greffent 4 groupements dont en général deux contiennent également du carbone. En procédant ainsi, les acides aminés ont une représentation graphique similaire, si la regle était respectée, le nom et la représentation de la molécule dépendrait de la chaine latérale et serai très différente pour chacun des membres de la famille, la methode traditionnelle reflète davantage la réalité du monde vivant.
 Un atome de carbone peut établir 4 liaisons avec des atomes voisins.
Le cas le plus simple est quand il est lié à un atome d'hydrogène.
D'une manière générale, quand un atome de carbone
n'est pas lié à quelque chose, il est lié à
un atome d'hydrogène. Il est donc d'usage en chimie organique de
ne pas représenter les hydrogènes liés à un
carbone, seule les autres atomes ou groupements sont représentés,
le lecteur se chargeant au besoin de compléter avec autant d'atome
d'hydrogène que nécessaire pour arriver à 4 liaisons.
Mais attention, ce n'est pas parce qu'ils ne sont pas représentés
qu'ils sont absent, il faudra notament en tenir compte dans les réactions
chimique.
Un atome de carbone peut établir 4 liaisons avec des atomes voisins.
Le cas le plus simple est quand il est lié à un atome d'hydrogène.
D'une manière générale, quand un atome de carbone
n'est pas lié à quelque chose, il est lié à
un atome d'hydrogène. Il est donc d'usage en chimie organique de
ne pas représenter les hydrogènes liés à un
carbone, seule les autres atomes ou groupements sont représentés,
le lecteur se chargeant au besoin de compléter avec autant d'atome
d'hydrogène que nécessaire pour arriver à 4 liaisons.
Mais attention, ce n'est pas parce qu'ils ne sont pas représentés
qu'ils sont absent, il faudra notament en tenir compte dans les réactions
chimique.
Un cas de representation encore plus extreme consiste à ne pas représenter non plus les atomes de carbone, mais juste les liaisons entre eux. On en arrive à la représentation la plus schématique ou l'on nedessine que le squelette des chaines carbonées. Ce squelette est repré par une ligne brisé, chaque angle étant un atome de carbone, et aucune représentation pour les atomes d'hydrogène qui sont ajoutés sur la chaine par le lecteur en fonction des besoins.
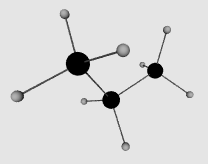
Dans les exemples qui vont suivre, nous allons partir d'un alcane de base, le propane représenté ci contre, que nous allons modifier pour illustrer les diffrérents groupements organiques. Le code couleur est standard : hydrogène blanc, carbone noir, azote bleu, oxygène rouge et soufre jaune (le code comprend aussi phosphate marron, iode violet et chlore vert, qui ne sont pas utilisés ici).
|
Les hydroxydes sont des molécules faiblement polaires mais neutres. |
 |
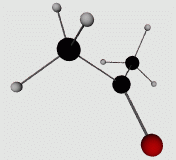
En augmentant l'oxydation d'un groupement hydroxyle, on perd l'hydrogène et l'oxygène établit une double liaison avec le carbone qui le porte. Si cet atome d'oxygène est situé à une extrémité de la chaine (l'atome de carbone est lié à un carbone d'un coté et un hydrogène de l'autre) on a un aldéhyde (image de gauche), situé au centre de la chaine (l'atome de carbone est lié à deux autres carbones) ont obtient un cétone (image de droite). Bien qu'apparement similaire, ces deux familles ont des propriétés différentes qui justifient l'existence de deux groupes. Les cétones notament ne pas être oxydés davantage alors que les aldéhydes le peuve. Aldéhydes et cétones permettent de différencier les deux grandes familles de glucides monomériques, les aldoses (tel que le glucose) et les cétoses (dont le fructose). |
 |
|
Quand la chaine qui se rattache au groupement acide est de type hydrocarbure de plus de 7 atomes de carbones, l'acide est dit gras. Ces molécules se trouvent dans les lipides. Le groupement acide est par ailleurs présent dans les acides aminés, la brique de base des protéines. |
|
Les amines sont des groupements basique. Une molécule portant à la fois un groupement acide carboxylique et un amine est appelé acide aminé. |
|
|